Thérapie géniques et modèles des maladies neurodégénératives
Notre laboratoire explore différentes approches de transfert de gènes pour développer des thérapies géniques efficaces contre les maladies dégénératives de la rétine et pour créer des modèles animaux de maladies humaines imitant précisément les mécanismes moléculaires de la maladie.
Présentation
La thérapie génique consiste à utiliser du matériel génétique pour traiter, guérir ou prévenir une maladie ou une affection médicale causée par une protéine déficiente ou dysfonctionnelle. Elle implique l'introduction de matériel génétique dans une cellule cible. Le principe de la thérapie génique repose sur le transfert d'un gène thérapeutique à l'aide de vecteurs viraux (adénovirus, virus adéno-associés, lentivirus, virus herpès) ou non viraux (liposomes cationiques et polymères), grâce auxquels les cellules du patient commenceront à produire des protéines qui corrigeront une maladie génétique ou acquise. Au cours de la dernière décennie, des progrès significatifs ont été réalisés dans notre compréhension des mécanismes moléculaires et génétiques des dégénérescences rétiniennes héréditaires. Grâce à ces connaissances, nous avons désormais la possibilité de développer des thérapies géniques pour un grand nombre de maladies rétiniennes. Ainsi, notre premier objectif est de développer le virus adéno-associé (AAV) comme vecteur pour le transfert de gènes thérapeutiques vers la rétine et de l'adapter aux différents défis qui se posent lors de maladies rétiniennes.
L'AAV est un virus non pathogène et non immunogène qui permet un transfert de gènes sûr et efficace in vivo. En utilisant ce vecteur, nous développons trois stratégies distinctes pour lutter contre les maladies dégénératives de la rétine.
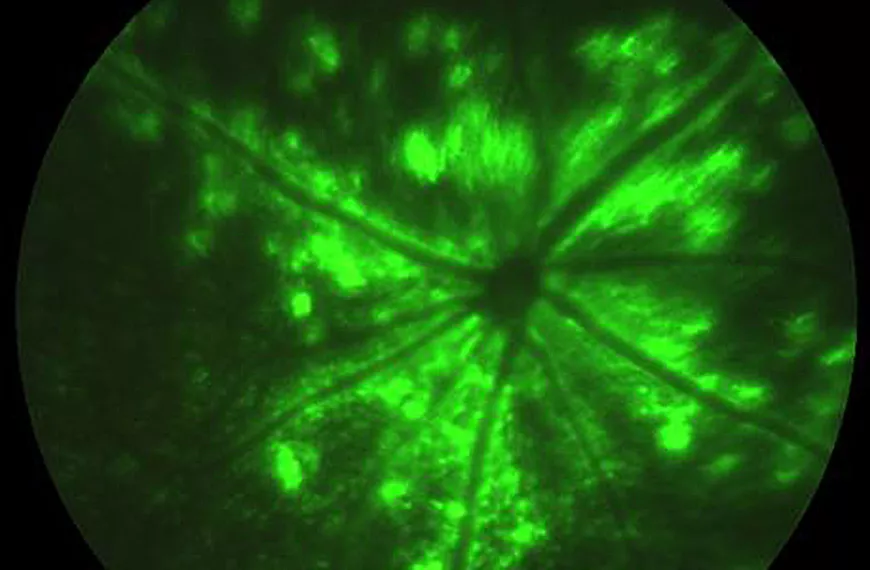
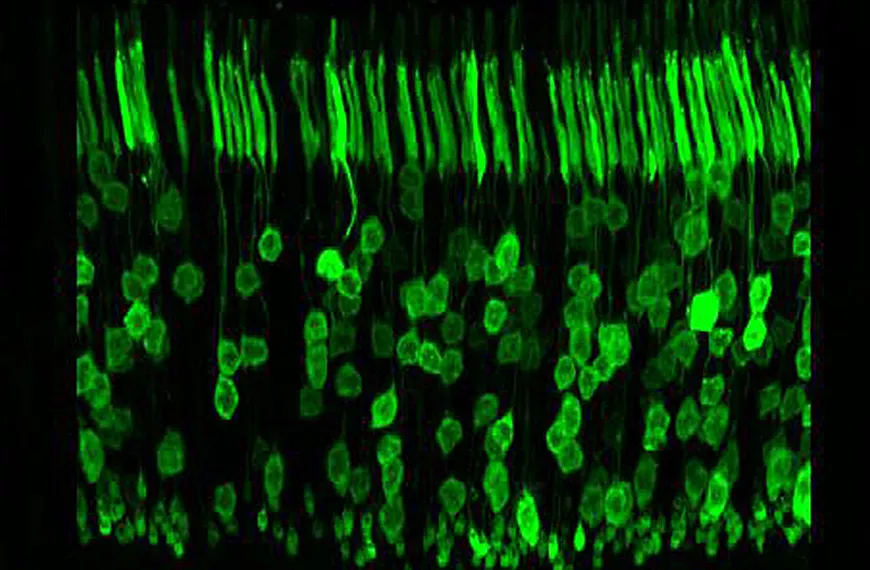
La stratégie la plus logique pour le traitement de la rétinopathie pigmentaire est la thérapie génique de remplacement traditionnel et la thérapie par suppression génique, ciblant les cellules photoréceptrices de la rétine. En utilisant des stratégies rationnelles et combinatoires, nous avons créé des AAV capables de transduire efficacement ce type de cellule pertinent pour le traitement, que ce soit pour le remplacement génique ou des stratégies génétiques plus complexes telles que l'épissage transitoire pour la réparation de l'ARNm ou l'édition du génome en utilisant les systèmes TAL nucléases ou CrisprCas9. Grâce aux développements de ces technologies émergentes et aux améliorations des vecteurs ciblant les photorécepteurs de la rétine, nous pouvons espérer proposer des traitements pour les formes dominantes de la rétinopathie pigmentaire.
Les maladies à la fois génétiques et environnementales (telles que la dégénérescence maculaire liée à l'âge et le glaucome) sont beaucoup plus courantes que les maladies monogéniques. Les thérapies géniques pour ces maladies, ainsi que pour les maladies sans composante génétique connue, reposent souvent sur le transfert d'un gène neuroprotecteur. Nous sommes intéressés par le développement de cette stratégie thérapeutique génique alternative basée sur le transfert de gènes neuroprotecteurs ou anti-apoptotiques. Ce mode de thérapie génique repose également sur notre capacité à manipuler efficacement les vecteurs à base d'AAV pour cibler divers types de cellules dans la rétine. Nous avons créé un certain nombre de sérotypes d'AAV présentant des propriétés souhaitables dans ce contexte.
L'administration d'outils optogéniques à différents types de cellules rétiniennes pour restaurer les réponses visuelles dans les rétines ayant subi une dégénérescence des photorécepteurs est une approche innovante pour restaurer les réponses visuelles dans les rétines aveugles. Ces dernières années, la transformation des neurones de deuxième et troisième ordre non photosensibles de la rétine en cellules photoréceptrices à l'aide d'outils optogéniques a été largement explorée dans les rétines de rongeurs. Le succès de ces stratégies prothétiques dépend du choix du bon outil optogénique et de la limitation de son expression au bon type de cellule. L'utilisation d'AAV modifiés pour administrer de nouveaux ensembles d'outils optogéniques aux cellules rétiniennes nous permettra de développer de multiples options de traitement une fois que la rétine aura perdu sa capacité de capturer la lumière. De plus, pour faire avancer cette stratégie vers la clinique, nous explorons et optimisons l'expression des canaux photosensibles à partir de vecteurs AAV dans les rétines de primates non humains.
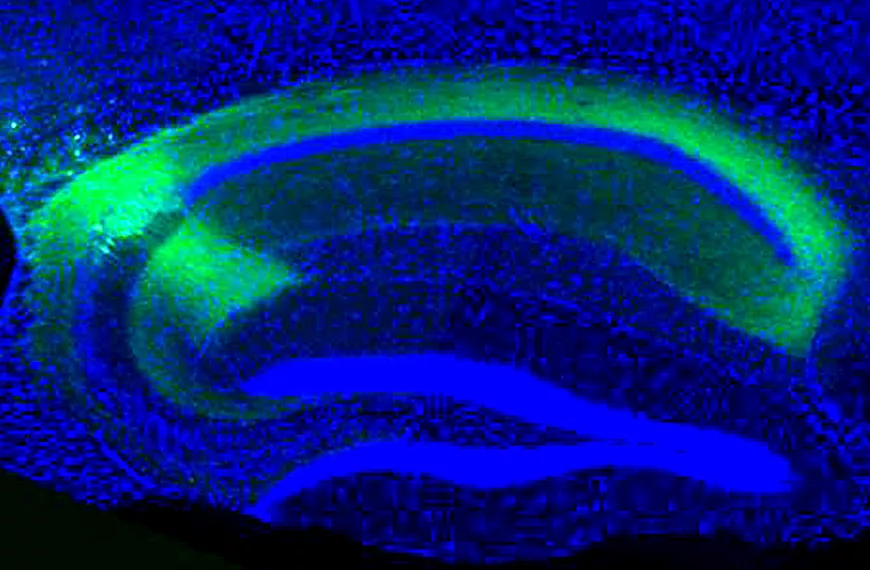
Le transfert de gènes étant également un outil de recherche, nous nous intéressons à l'administration de gènes responsables de pathologies pour créer des modèles animaux de maladies humaines imitant précisément les mécanismes moléculaires de la maladie. Le choix des animaux modèles est crucial pour la recherche translationnelle car il permet la validation préclinique des stratégies thérapeutiques. Grâce à nos vecteurs de transfert de gènes modifiés et à nos connaissances sur les mécanismes des maladies neurodégénératives de la rétine, nous pouvons envisager de reproduire un certain nombre de pathologies par transgénèse somatique, notamment dans les cas où des modèles animaux imitant la maladie humaine ne sont pas disponibles.
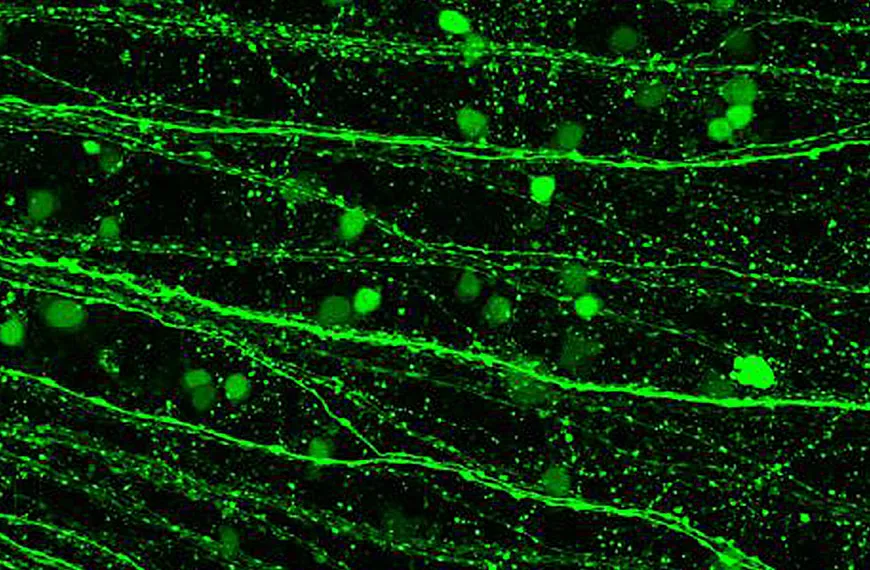
Enfin, nous nous intéressons au développement de vecteurs viraux adéno-associés comme outils pour étudier le système visuel. La petite taille de l'AAV permet une diffusion facile à travers le tissu neural et conduit à une expression génique continue après une injection unique, ce qui en fait un choix très favorable pour le transfert de gènes dans le tissu neural. De plus, l'AAV présente certaines propriétés de marquage rétrograde et antérograde. Cependant, le principal point faible de l'AAV est sa capacité de transport limitée. Actuellement, les AAV ne permettent pas un marquage trans-synaptique efficace. En raison des lacunes des outils viraux pour le traçage des circuits, nous sommes intéressés par le développement d'AAV pour le faire plus efficacement.

Domaines de recherche
- Développement de thérapies géniques basées sur AAV pour les maladies rétiniennes.
- Modèles animaux de maladies neurodégénératives humaines.
- Développement de nouveaux vecteurs AAV pour le transfert de gènes vers la rétine.
- Comprendre les changements de distribution virale dans les rétines atteintes de maladies.
Les membres de l'équipe
Publications scientifiques
Vous trouverez ci-dessous les dernières publications scientifiques dans le domaine : Thérapie géniques et modèles des maladies neurodégénératives.








